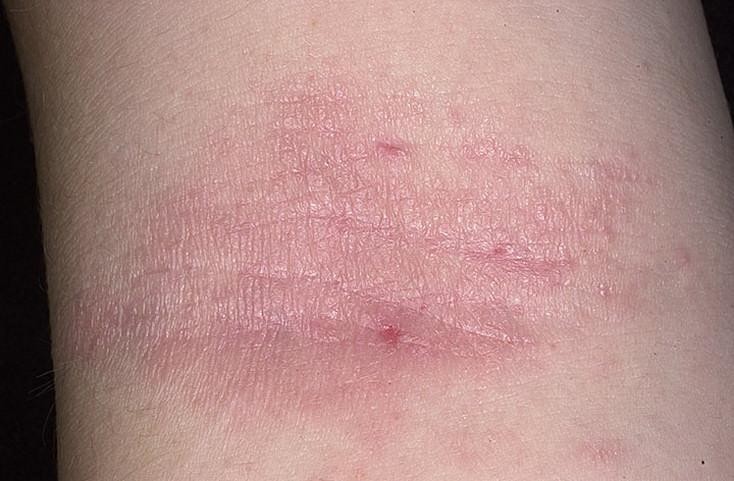
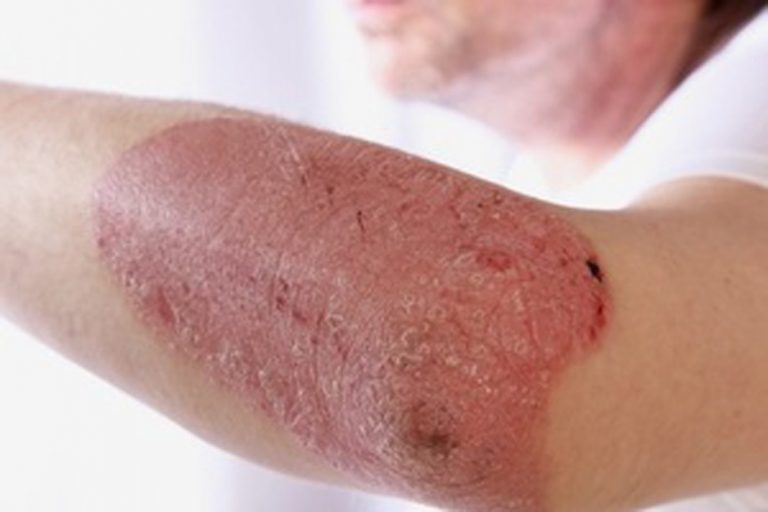
Екзема, псоріаз
Вісник дерматології і венерології, № 5-1998, стор. 37–40.
Вміст біотину в сироватці крові у хворих на екзему та псоріаз
А. Л. Тищенко
Кафедра шкірних та венеричних хвороб, курс захворювань, що передаються статевим шляхом, Російського Університету дружби народів, Москва
Розроблено оригінальну методику мікробіологічного визначення біотину (вітамін B8, або вітамін H) в сироватці крові (2 мл), яка за допомогою ферменту лужної фосфатази дозволяє досліджувати вільну, пов’язану з білками і загальну форму цього вітаміну. Значний дефіцит біотину виявлений у хворих на екзему та псоріаз. Більш виражене зниження вмісту вітаміну B8, особливо його пов’язаної з білками форми, спостерігається також у хворих на екзему та псоріаз, які зловживають алкоголем, що вказує на доцільність використання біотину в комплексному лікуванні цих дерматозів.
Біотин (вітамін B8, H, або антисеборейний чинник) – органічна сполука, необхідна для тканинного росту, що має в своєму складі сірку.
Біотин міститься в продуктах, у яких є вітаміни групи В. Найбільше його в печінці, нирках, соєвому борошні, яєчному жовтку, дріжджах і горосі. В організмі людини біотин синтезується бактеріями кишечника. Біотин необхідний для здійснення нормальних енергетичних процесів, для росту, для синтезу жирних кислот, антитіл, травних ферментів і метаболізму нікотинової кислоти. Цей вітамін володіє інсуліноподібною активністю і знижує вміст цукру в крові [2, 4]. Відомо близько десяти ферментативних систем, для роботи яких необхідний біотин. При нестачі біотину у людини спостерігаються загальна слабкість, втрата апетиту, нудота, депресія, сонливість, підвищена стомлюваність, дратівливість, хворобливість і слабкість м’язів, а також суха або жирна себорея шкіри, осередкове облисіння і лупа [4, 9]. Язик блідий і гладкий, слизові оболонки рота і гортані сірого (безкровного) кольору. У крові знижується вміст гемоглобіну і підвищується рівень холестерину і цукру [2, 3]. Один з компонентів яєчного білка – авідин – має здатність зв’язувати біотин, утворюючи з ним нерозчинне з’єднання. В експерименті при вживанні в їжу великої кількості сирого яєчного білка розвивається себорейний, а надалі ексфоліативний дерматит із випаданням волосся і нігтів. Призначення біотину ліквідує цей процес. Звідси виникло припущення, що себорея і випадіння волосся можуть бути якоюсь мірою пов’язані з нестачею вітаміну B8, тому його і назвали антисеборейним чинником [11].
Є окремі повідомлення про ефективність біотину при призначенні його хворим на нейродерміт, дисгідроз, екзему, некротичне акне і псоріаз. Показана ефективність застосування вітаміну B8 в лікуванні дітей, які страждають на хворобу Ріттера, себорейною екземою і хворобою Лейнера-Мусу [9, 11].
Матеріал і методи
Для кількісного визначення біотину в сироватці крові нами був використаний як базовий вітчизняний мікробіологічний метод, запропонований Н. А. Помощніковою для визначення вмісту вітамінів B5 та B6 в рослинних об’єктах [6, 7]. Щодо крові Е. М. Рахмалевич і Л. Д. Тищенко в 1963 році розробили мікробіологічні методики визначення вільної, пов’язаної з білками і загальної форми вітамінів B5 та B6 в крові [8]. Пізніше, в 1975 році, на основі цих методик тими ж авторами були розроблені нові мікробіологічні методики визначення вітамінів B1 і PP в крові, включаючи вільну, пов’язану з білками і загальну форму цих вітамінів [10]. Одночасно цими ж авторами також була розроблена й випробувана в клінічних умовах мікробіологічна методика визначення в крові біотину.
Методика визначення біотину в сироватці крові
Як індикаторна культура в цьому методі використовується вельми чутлива дріжджова культура Saccharomycodes ludwigii KМ. Кількість біотину визначається по наростаючій масі дріжджів. Застосовувана для проведення досліду дріжджова культура вирощується на сусло-агарі, приготованому з сусла (7 Bal) з додаванням 2% агару. Для дослідження використовується свіжа культура дріжджів, пересіяна за 1–2 доби до досліду на сусло-агар і зберігається до цього в термостаті при 27C.
Для свого зростання дріжджова культура потребує отримання ззовні вітамінів: тіаміну, піридоксину, біотину, нікотинової та пантотенової кислот. Індикаторна (дріжджова) культура призначається для засівання вітамінізованого цукромінерального середовища Рідера при проведенні дослідження. До складу середовища Рідера, з розрахунку на 5 л, входять такі інгредієнти: сахароза (2%), сульфат амонію (0,3%), сульфат магнію (0,07%), кухонна сіль (0,05%), нітрат калію (0,04%), дигідрофосфат калію (0,1%) і гідрофосфат калію (0,01%).
Середовище Рідера готується на кип’яченій водопровідній воді і стерилізується в автоклаві при 0,5 атм протягом 30 хв. Доцільно готувати миттєво не менше 5 л середовища Рідера з подальшою розфасовкою в колби місткістю 500 мл. При підготовці середовища Рідера кожен складовий її інгредієнт розчиняється окремо в 50–100 мл кип’яченої води і фільтрується через змочений водою паперовий фільтр. Сахароза в кількості 100 г розчиняється в 500 мл кип’яченої води, куди потім для просвітлення розчину додається 25 г активованого вугілля. Цей розчин струшується протягом 45 хв на Шидль-апараті, після чого розчин фільтрується, а ретентат (залишок) промивається 4–5 разів кип’яченою водою. Автоклавоване середовище зберігається в прохолодному місці. Напередодні досліду проводиться повторне автоклавування. Якщо при автоклавуванні середовища Рідера утворився осад, його необхідно розчинити додаванням 20–30% сірчаної кислоти. Середовище нейтралізують 10–15% розчином їдкого натрію і за допомогою індикатора бромтимолблау доводять pH до 5,6–6,2.
Робочі розчини для тіаміну, нікотинової та пантотенової кислот готуються в концентрації по 1000 мкг в 1 мл і для піридоксину – по 100 мкг в 1 мл.
Розчини тіаміну, піридоксину і нікотинової кислоти готують з кристалічних вітамінів (B1, B6 і PP), розчин пантотенової кислоти – з кальцію пантотенату фірми “Gedeon Richter” або “Walsh Pharma”. Для приготування робочого (а для піридоксину – основного) розчину цих вітамінів кожен з них точно відважують в невеликій кількості на спеціальних електронних або електричних вагах і розчиняють у рівній взятій масі кількості мілілітрів дистильованої води (наприклад, 10,2 мг – в 10,2 мл води). 1 мл такого розчину буде містити 1000 мкг вітаміну. Робочий розчин піридоксину готується шляхом розведення дистильованою водою основного розчину вітаміну B6 в 10 разів. Приготовлені розчини вітамінів стерилізують на киплячій водяній бані протягом 5 хв. Зберігати основні та робочі розчини вітамінів необхідно в холоді. Термін придатності робочих розчинів – 1 міс.
Побудова стандартної калібрувальної кривої по біотину для обчислення результатів дослідження проводиться таким чином: за 1–2 доби до досліду індикаторну дріжджову культуру пересівають на сусло-агар і витримують в термостаті при 27 C. Перед дослідом з культури, що виросла, готують розведену суспензію на стерильній водопровідній воді (концентрація дріжджів близько 0,01%). До 500 мл середовища Рідера додається тіамін, нікотинова і пантотенова кислоти по 1000 мкг і піридоксин по 100 мкг, тобто по 1 мл кожного з робочих розчинів вітамінів. Середовище стерильно розливають по 10 мл у невеликі ерленмеєрівські колби. У низку таких колб з вітамінізованим цукромінеральним середовищем Рідера послідовно додають усі зростаючі кількості (мкг) біотину, розчин якого готується на бідистильованій воді зі стандартного, кристалічного d-biotine фірми “Roche”. При цьому в 1-у колбу додається 1 мл розчину біотину, в якому міститься 1 мкг вітаміну B8, в 2-у – 2 мкг, в третій – 4 мкг, в 4-у – 8 мкг, після чого кількість доданого в колби біотину збільшують не в геометричній, а в арифметичній пропорції, тобто в кожну наступну колбу додають розчин біотину, що містить 12, 16, 20, 24, 28, 32, 36 мкг і т. д. до 160 мкг вітаміну B8.
Колби засівають однією краплею свіжоприготованої дріжджової культури і поміщають у термостат при 27 C на 40–48 год, після чого вміст колб фільтрують через попередньо зважені мембранні фільтри (№ 4), змонтовані на приладі Зейца. Фільтри з осадом висушують при кімнатній температурі до постійної маси. Викреслюють стандартну криву, по осі абсцис відкладають значення маси висушеної індикаторної, дріжджової культури, по осі ординат – відповідну концентрацію розчину біотину. Стандартна калібрувальна крива будується на підставі середніх даних трикратно повтореного досвіду.
Після побудови стандартної кривої переходять до визначення вмісту вільної форми біотину в крові. За цією методикою для визначення біотину необхідно 5 мл крові. Методом центрифугування отримують 2,5 мл сироватки.
Хід дослідження: досліджувану сироватку крові за допомогою мікропіпетки вносять по 1 мл в колби з вітамінізованого середовища Рідера (10 мл) і засівають 1 краплею свіжоприготованої дріжджової культури. Колби витримують 40–48 год у термостаті при 27 C, після чого їхній вміст фільтрують за допомогою приладу Зейца через попередньо зважені мембранні фільтри №4. Висушені при кімнатній температурі фільтри зважують. Приріст маси дріжджів служить для розрахунку вмісту біотину за стандартною кривою. Для обчислення вільної форми біотину в 100 мл сироватки крові показання стандартної кривої множать на 100. Помилка методу при визначенні вільної форми біотину становить 2%. При клінічних дослідженнях такий відсоток помилки вважається допустимим.
Описаний вище метод був використаний при обстеженні 34 здорових осіб віком від 19 до 45 років.
Вміст вільної форми біотину в сироватці крові здорових людей коливався від 18 до 41 нг% і становив у середньому 28,1 0,2 нг%, що відповідало показникам вмісту біотину в сироватці крові здорових людей, отриманим Ю. М. Островським [5].
Визначення загальної форми біотину в сироватці крові проводилося нами за методом ферментативного розщеплення білкових комплексів біотину за допомогою лужної фосфатази [1, 12]. На жаль, приготування органної лужної фосфатази доступно не всім лабораторіям і її якість необхідно постійно контролювати. Перевагою лужної фосфатази є те, що вона стабільна в замороженому стані протягом 16 міс. Крім того, гемолітичні властивості крові не мають істотного впливу на її активність, яка в нормі становить 3–13 од.
Дослідження загальної форми біотину в сироватці крові проводиться так само, як і визначення вільної форми, з тією лише різницею, що в пробірку з 1 мл досліджуваної сироватки додають ще 0,1 мл лужної фосфатази, після чого її вміст протягом 1 години витримують на водяній бані при 60 C. Потім вміст пробірки переносять у колби, у які попередньо поміщають по 10 мл вітамінізованого цукромінерального середовища Рідера. Результати дослідження визначають за стандартною кривою, побудованої аналогічним чином при використанні сироватки, обробленої лужною фосфатазою, і відбиває зростання дріжджової культури залежно від присутнього в сироватці загальної кількості біотину. Як виявилося, вміст загальної форми біотину у здорових людей коливається від 30 до 80 нг% і становить у середньому 56,3 0,2 нг%.
Дослідження загальної та вільної форм біотину в сироватці крові дозволяє визначити пов’язану з білками форму вітаміну B8, рівень якої відповідає різниці між змістом загальної та вільної форм цього вітаміну. У здорових людей рівень пов’язаної з білками форми біотину в сироватці крові становить 28,2 0,2 нг%.
Результати та обговорення
Описаним вище мікробіологічним методом визначення біотину в крові було обстежено 83 хворих екземою та псоріазом, включаючи хворих, що зловживають алкоголем. Зведені результати лабораторних досліджень представлені в таблиці.
| Вміст біотину (в нг%) в крові хворих екземою та псоріазом | ||||
| Діагноз | Кількість хворих | Форма біотину | ||
| вільна | зв’язана | загальна | ||
| Псоріаз | 31 | 13,9 2,1 | 26,3 1,3 | 40,2 1,5 |
| Псоріаз + зловживання алкоголем | 23 | 18,8 1,3 | 6,7 1,0 | 25,5 1,7 |
| Екзема істинна | 20 | 14,4 1,2 | 26,9 1,5 | 41,3 1,8 |
| Екзема + зловживання алкоголем | 9 | 20,2 2,7 | 6,2 1,4 | 26,4 4,5 |
| Норма | 34 | 28,1 0,2 | 28,2 0,2 | 56,3 0,2 |
Як видно з таблиці, у хворих на псоріаз та екзему, не обтяжених алкогольним чинником, рівень вільної форми біотину в крові був знижений в 2 рази в порівнянні з нормою. Вміст його в крові складав у хворих на псоріаз – 13,9 2,1 нг%, у хворих на екзему – 14,4 1,2 нг% (норма 28,1 0,2 нг%). У хворих цієї групи вміст пов’язаної з білками форми біотину не було знижено і він варіював у межах норми. Вміст загальної форми вітаміну B8 у них було знижено незначно: в 1,4 рази – у хворих на псоріаз (40,2 1,5 нг%) і в 1,3 разу – у хворих екземою (41,3 1,8 нг%). У хворих, що зловживають алкоголем, вміст вільної форми біотину було також знижено незначно: у хворих на псоріаз – в 1,5 разу (18,8 1,3 нг%), у хворих екземою – в 1,4 разу (20,2 2, 7 нг%). У той же час у хворих на псоріаз та екзему вплив алкоголю виявлялося в значному (в 4,2 і 4,5 разу) зменшенні рівня пов’язаної з білками форми вітаміну B8 у крові (відповідно 6,7 1,0 і 6,2 1,4 нг%). У цих же хворих виявився зниженим (відповідно в 2,2 і 2,1 разу) вміст загальної форми біотину в крові (25,5 1,7 і 26,4 4,5 нг%; норма 56,3 0,2 нг%).
Використана в нашій роботі методика мікробіологічного визначення біотину за допомогою ферментативного розщеплення білкових компонентів цього вітаміну дозволяє більш глибоко оцінити порушення обміну цього вітаміну у хворих не екзему та псоріаз. Визначення однієї вільної або загальної форми цього вітаміну не відображає досить повно стан дефіциту вітаміну B8.
Мабуть, найбільш інформативним є показник пов’язаної з білками форми вітаміну, зміни якого відображають більший ступінь тяжкості патологічного процесу в організмі хворого.
Ймовірно, на першому етапі формування дефіциту біотину організм прагне максимально зберегти рівень пов’язаної з білками форми цього вітаміну, який забезпечує найбільш важливі функції в обміні речовин. З цією метою використовуються всі резерви біотину, які знаходяться в організмі у вигляді вільної форми цього вітаміну. Це відбувається до тих пір, поки в організм людини поступає достатня кількість вітаміну B8 або поки синтез біотину в організмі здатний забезпечити підтримання концентрації цього вітаміну в крові на необхідному рівні. У міру наростання дефіциту біотину відбувається порушення процесів біотрансформації в його активний, коферментний стан, що і виражається в зменшенні вмісту зв’язаної з білками форми цього вітаміну.
Висновок
Таким чином, отримані нами дані вказують на те, що при таких хронічно рецидивуючих дерматозах, як екзема і псоріаз, має місце певна недостатність біотину. Значне зниження вмісту біотину в сироватці крові, особливо його пов’язаної з білками форми, спостерігається також у хворих е екзему та псоріаз, що зловживають алкоголем. Все це вказує на доцільність і патогенетичну обґрунтованість застосування біотину при лікуванні хворих з цими дерматозами. Сьогодні в медицині найчастіше застосовується d-biotine фірми “Roche”, який випускається в ампулах для парентерального введення по 1 мл (5 мг). Постановою фармакологічного комітету МОЗ РФ (протокол № 5, 28.11.96) дозволений випуск вітчизняного біотину, який виробляється як в ампульованій формі у вигляді 0,05% і 0,1% розчину в 1 мл, так і в таблетованій формі по 0005 (5 мг).
Література
- Асатиани В. С. Ферментные методы анализа. – М.: Наука,1969;740.
- Идз М. Д. Витамины и минеральные вещества. – Ст-Петербург: КОМПЛЕКТ, 1996;503.
- Лоу К. Все о витаминах. – М: КРОН-ПРЕСС, 1995; 311.
- Обербайл К. Витамины-целители. – Минск: Парадокс, 1997;448.
- Островский Ю. М. Механизмы межвитаминных взаимоотношений. – Минск: Наука и техника, 1973; 263.
- Помощникова Н.А. Микробиологический метод определения пиридоксина. В кн.: Витаминные ресурсы и их использование. – М.: АН СССР, 1955;3:145 – 151.
- Помощникова Н. А. Микробиологический метод определения пантотеновой кислоты. – М.: АН СССР, 1955; 3: 152 – 157.
- Рахмалевич Е.М., Тищенко Л. Д. Микробиологический метод определения свободной и общей пантотеновой кислоты в крови: Сб. науч. трудов ЦКВИ МЗ СССР. – М.,1963; 132 – 137.
- Студницин А. А., Тищенко Л. Д. Витамины в дерматологии. – М.: Медицина, 1969;167.
- Тищенко Л.Д., Рахмалевич Е.М. Микрометод определения витаминов B1 и PP в крови. В кн.: Методы исследования функций организма в онтогенезе. – М.: АПН СССР, 1975; 160 – 169.
- Тищенко Л.Д. Витамины в дерматологии (учебное пособие). – М.: УДН,1987;94.
- Тищенко Л.Д., Рахмалевич Е.М. Инструкция по постановке метода микробиологического определения биотина в сыворотке крови с помощью ферментативного расщепления белковых компонентов витамина (метод. письмо). – М.: Минзвуз СССР, 1985;1 – 4.